 La nostra ricerca si concentra sulla comprensione dei meccanismi molecolari attraverso i quali mutazioni nella rodopsina e nei geni che ne regolano il traffico portano a malattie della retina. La rodopsina è un costituente principale delle membrane sensibili alla luce delle cellule fotorecettrici dei bastoncelli retinici, dove funziona come un GPCR sensibile alla luce che avvia la cascata di fototrasduzione. La rodopsina è anche un regolatore centrale della salute dei fotorecettori ed è soggetta a oltre 150 diverse mutazioni che causano la retinite pigmentosa. Le mutazioni che colpiscono la rodopsina C-terminale causano forme gravi di retinite pigmentosa autosomica dominante (ADRP). Nel corso della nostra ricerca, abbiamo definito il motivo VxPx C-terminale della rodopsina come un segnale di targeting ciliare conservato (CTS). Abbiamo identificato i costituenti del complesso di targeting ciliare che riconosce questo segnale per regolare il traffico di rodopsina e il rinnovamento della membrana dei fotorecettori dei bastoncelli retinici.
La nostra ricerca si concentra sulla comprensione dei meccanismi molecolari attraverso i quali mutazioni nella rodopsina e nei geni che ne regolano il traffico portano a malattie della retina. La rodopsina è un costituente principale delle membrane sensibili alla luce delle cellule fotorecettrici dei bastoncelli retinici, dove funziona come un GPCR sensibile alla luce che avvia la cascata di fototrasduzione. La rodopsina è anche un regolatore centrale della salute dei fotorecettori ed è soggetta a oltre 150 diverse mutazioni che causano la retinite pigmentosa. Le mutazioni che colpiscono la rodopsina C-terminale causano forme gravi di retinite pigmentosa autosomica dominante (ADRP). Nel corso della nostra ricerca, abbiamo definito il motivo VxPx C-terminale della rodopsina come un segnale di targeting ciliare conservato (CTS). Abbiamo identificato i costituenti del complesso di targeting ciliare che riconosce questo segnale per regolare il traffico di rodopsina e il rinnovamento della membrana dei fotorecettori dei bastoncelli retinici.
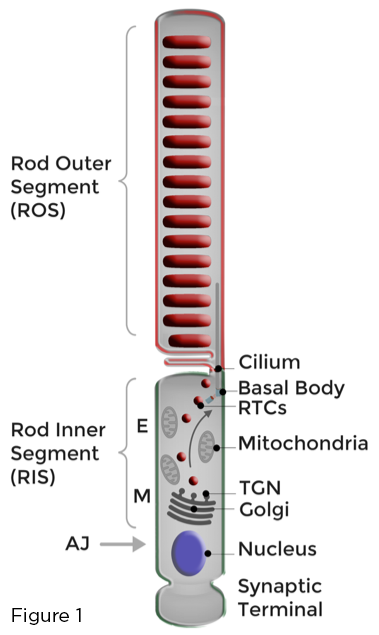 La base per la funzione ottimale dei fotorecettori dei bastoncelli è la rigida compartimentazione delle membrane fotosensibili cariche di rodopsina al ciglio primario modificato in modo univoco che forma il segmento esterno dei bastoncelli (ROS). L'omeostasi dei fotorecettori dei bastoncelli è mantenuta dal continuo rifornimento delle membrane ROS danneggiate dalla luce e dall'efficiente sequestro di proteine e lipidi ROS coinvolti nella fototrasduzione, lontano da quelli impegnati in diverse funzioni cellulari che si svolgono nel corpo cellulare adiacente chiamato il segmento interno dei bastoncelli (RIS), o al terminale sinaptico del bastoncino. Golgi e altri organelli biosintetici sono localizzati nel RIS, nella regione mioide (M). Il traffico di membrana polarizzata nei bastoncelli retinici comporta la sintesi, lo smistamento e il trasporto, attraverso il RIS, di quantità prodigiose di vettori di trasporto della rodopsina diretti dal Golgi alle ciglia (RTC). Gli RTC attraversano la regione ellissoide (E) piena di mitocondri e si fondono con la membrana plasmatica RIS in prossimità del ciglio. Le membrane appena sintetizzate vengono quindi consegnate al ROS (Figura 1).
La base per la funzione ottimale dei fotorecettori dei bastoncelli è la rigida compartimentazione delle membrane fotosensibili cariche di rodopsina al ciglio primario modificato in modo univoco che forma il segmento esterno dei bastoncelli (ROS). L'omeostasi dei fotorecettori dei bastoncelli è mantenuta dal continuo rifornimento delle membrane ROS danneggiate dalla luce e dall'efficiente sequestro di proteine e lipidi ROS coinvolti nella fototrasduzione, lontano da quelli impegnati in diverse funzioni cellulari che si svolgono nel corpo cellulare adiacente chiamato il segmento interno dei bastoncelli (RIS), o al terminale sinaptico del bastoncino. Golgi e altri organelli biosintetici sono localizzati nel RIS, nella regione mioide (M). Il traffico di membrana polarizzata nei bastoncelli retinici comporta la sintesi, lo smistamento e il trasporto, attraverso il RIS, di quantità prodigiose di vettori di trasporto della rodopsina diretti dal Golgi alle ciglia (RTC). Gli RTC attraversano la regione ellissoide (E) piena di mitocondri e si fondono con la membrana plasmatica RIS in prossimità del ciglio. Le membrane appena sintetizzate vengono quindi consegnate al ROS (Figura 1).
L'ordinamento in RTC è regolato dalle piccole GTPasi delle famiglie Rab e Arf che svolgono un ruolo centrale nell'organizzazione del traffico di membrana intracellulare e nella consegna della membrana alle ciglia primarie. Le proteine coinvolte nella formazione e nel mantenimento delle ciglia sono codificate da circa il 25% dei geni delle malattie retiniche ereditarie, con mutazioni che causano degenerazione retinica, reni cistici, obesità e difetti del tubo neurale in un'ampia gamma di malattie genetiche, note collettivamente come ciliopatie.
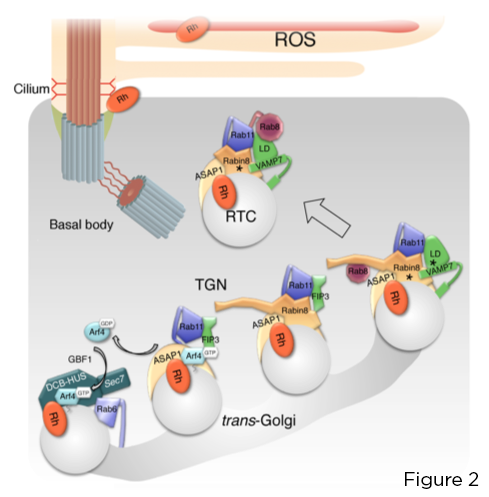 La piccola GTPasi Arf4 riconosce e si lega direttamente alla rodopsina C-terminale VxPx CTS. Arf4, attivato al fotorecettore Golgi dal fattore di scambio di nucleotidi guanina Arf (GEF) GBF1, avvia un assemblaggio graduale del nesso di targeting centrato sulla proteina attivante Arf GTPasi (GAP) ASAP1, che media l'idrolisi GTP su Arf4 e Rab11a -Complesso doppio effettore FIP3-Rabin8. Questo complesso controlla l'assemblaggio del modulo di targeting Rab11a-Rabin8-Rab8 altamente conservato che recluta direttamente R-SNARE VAMP7 su RTC per regolare la loro fusione alla base ciliare, tramite l'accoppiamento VAMP7 con la membrana plasmatica affine sintassina 3 SNARE e SNAP-25 (Figura 2).
La piccola GTPasi Arf4 riconosce e si lega direttamente alla rodopsina C-terminale VxPx CTS. Arf4, attivato al fotorecettore Golgi dal fattore di scambio di nucleotidi guanina Arf (GEF) GBF1, avvia un assemblaggio graduale del nesso di targeting centrato sulla proteina attivante Arf GTPasi (GAP) ASAP1, che media l'idrolisi GTP su Arf4 e Rab11a -Complesso doppio effettore FIP3-Rabin8. Questo complesso controlla l'assemblaggio del modulo di targeting Rab11a-Rabin8-Rab8 altamente conservato che recluta direttamente R-SNARE VAMP7 su RTC per regolare la loro fusione alla base ciliare, tramite l'accoppiamento VAMP7 con la membrana plasmatica affine sintassina 3 SNARE e SNAP-25 (Figura 2).
Al punto cruciale della cascata ciliare Rab11a-Rabin8-Rab8 c'è Rab8 GEF Rabin8, una proteina scaffold multifunzionale che interagisce con proteine ciliari selezionate, come il complesso di traffico TRAPPII e il BBSome, suggerendo un ruolo centrale nelle vie ciliari dei recettori sensoriali. La sua funzione è influenzata dalle mutazioni della chinasi NDR2 (STK38L), codificata dal gene della degenerazione retinica precoce (erd) canino corrispondente alla ciliopatia umana amaurosi congenita di Leber (LCA). Il nostro studio attuale mostra che GFP-Rabin8 umano espresso in transgenico X. laevis colocalizza con Rabin8 endogena e rodopsina al Golgi e sugli RTC, aprendo la strada a futuri studi sul ruolo di Rabin8 nella progressione di membrana lungo la via ciliare, che è potenzialmente interrotta nelle malattie degenerative retiniche ereditarie.
Nel complesso, i nostri studi hanno rivelato che il targeting di membrana verso i ROS è una forma conservata di targeting ciliare. Il motivo VxPx è presente in altre proteine di membrana ciliare. Il complesso di targeting basato su Arf4 conservato mira ai recettori sensoriali delle ciglia primarie attraverso intricate reti funzionali di piccole GTPasi e dei loro regolatori che sono squisitamente sensibili alle mutazioni che causano degenerazioni retiniche e ciliopatie.
Deretic D., Lorentzen E e Fresquez T. (2019). I pro ei contro del complesso di targeting della membrana ciliare basato su Arf4. Piccoli GTPasi. Piccole GTPasi. 2019 maggio 9: 1-12. doi: 10.1080/21541248.2019.1616355. [Epub prima della stampa]
Kandachar V, Tam BM, Moritz OL e Deretic D. (2018) Una rete di interazione tra SNARE VAMP7 e Rab-GTPases all'interno di un complesso di targeting per membrana ciliare. J Cell Sci. (2018) J Cell Sci. 2018 dic 10;131(24). pii: jcs222034. doi: 10.1242/jcs.222034.
Wang J., Fresquez T. Kandachar V. e Deretic D (2017). Arf GEF GBF1 e Arf4 sinergizzano con il carico del recettore sensoriale, la rodopsina, per regolare il traffico della membrana ciliare. J Cell Sci. J Cell Sci. 2017 dicembre 1;130(23):3975-3987. doi: 10.1242/jcs.205492. Epub 2017 12 ottobre.
Vetter M, Wang J, Lorentzen E e Deretic D. (2015) Nuova topografia della rete di interazione Rab11-effettore all'interno di un complesso di targeting per membrana ciliare. Piccole GTPasi. 2015 ottobre 2;6(4):165-73. doi: 10.1080/21541248.2015.1091539. Epub 2015 set 23.
Wang J e Deretic D. (2015) L'effettore Arf e Rab11 FIP3 agisce in sinergia con l'Arf GAP ASAP1 per dirigere Rabin8 nel targeting del recettore ciliare. J Cell Sci. J Cell Sci jcs.162925; Articolo anticipato online 11 febbraio 2015, doi:10.1242/jcs.162925 (2015).
Wang J. e Deretic D (2014). Complessi molecolari che dirigono il trasporto della rodopsina alle ciglia primarie. Prog Retin Eye Res. 2014 gennaio; 38:1-19. doi: 10.1016/j.preteyeres.2013.08.004. Epub 2013 ottobre 14
Wang J, Morita Y, Mazelova J e Deretic D. (2012). L'Arf GAP ASAP1 fornisce una piattaforma per regolare il targeting del recettore ciliare mediato da Arf4 e Rab11-Rab8. EMBO J 31, 4057-4071.
Mazelova J, Ransom N, Astuto-Gribble L, Wilson MC e Deretic D. (2009) Syntaxin 3 e SNAP-25 pairing, regolato dall'acido docosaesaenoico omega-3 (DHA), controlla la somministrazione di rodopsina per la biogenesi delle ciglia- organelli sensoriali derivati, i segmenti esterni dell'asta. J. Cell Sci. 122, 2003-2013.
Mazelova J, Astuto-Gribble L, Inoue H, Tam BM, Schonteich E, Prekeris R, Moritz OL, Randazzo PA e Deretic D. (2009) Il motivo di targeting ciliare VxPx dirige l'assemblaggio di un modulo di traffico attraverso Arf4. EMBO J. 28, 183-192.
Deretic D, Williams AH, Ransom N, Morel V, Hargrave PA e Arendt A. (2005) La rodopsina C-terminale, il sito di mutazioni che causano la malattia retinica, regola il traffico legandosi all'ARF4. Proc. Natl. Acad. Sci. STATI UNITI D'AMERICA. 102: 3301-3306.